Retour sur la décomposition de l'eau :
Lors de l'électrolyse de l'eau, des molécules d'eau disparaissent et des gaz apparaissent au niveau des électrodes (dihydrogène et dioxygène).
Définition 1 :
On appelle transformation chimique une transformation au cours de laquelle des substances disparaissent tandis que d'autres substances apparaissent.
Définition 2 :
Les corps qui disparaissent sont appelés les réactifs.
Définition 3 :
Les corps qui apparaissent sont appelés les produits.
L'électrolyse de l'eau est donc une transformation chimique.
La fusion d'un glaçon n'est pas une transformation chimique : avant ou après fusion, il s'agit de la même substance, c'est à dire l'eau ! (La fusion est en fait une transformation physique appelé changement d'état.)
Définition 4 :
On appelle bilan d'une transformation chimique l'écriture simplifiée selon le modèle :
"réactif 1 + réactif 2 + ...
→ produit 1
+ produit 2 + ... "
Le bilan de l'électrolyse de l'eau s'écrit donc :
eau → dihydrogène + dioxygène
Dessinons les modèles de ces molécules :
eau ( H2O )
dihydrogène ( H2 )
dioxygène ( O2 )

Nous comptons donc parmi
:
- les réactifs : 2 atomes hydrogène (blanc) et 1 atome oxygène (rouge),
- les produits : 2 atomes hydrogène (blanc) et 2 atomes oxygène (rouge).
Ce n'est pas équilibré ! Et c'est impossible lors d'une transformation chimique !
Lors d'une transformation chimique, aucun atome ne disparait ou n'apparait : il y a conservation des atomes.
En fait, le bilan indique les substances mais sans en préciser les proportions... (un peu comme si pour la recette d'une succulente pâtisserie, on nous donnait le nom de tous les ingrédients mais pas les proportions ! À moins d'un quatre-quart, des essais s'imposeront...)
Il faut ici en déduire que 2 molécules d'eau réagissent ensemble et 2 molécules de dihydrogène notamment sont formées. Dessinons tous ces modèles :
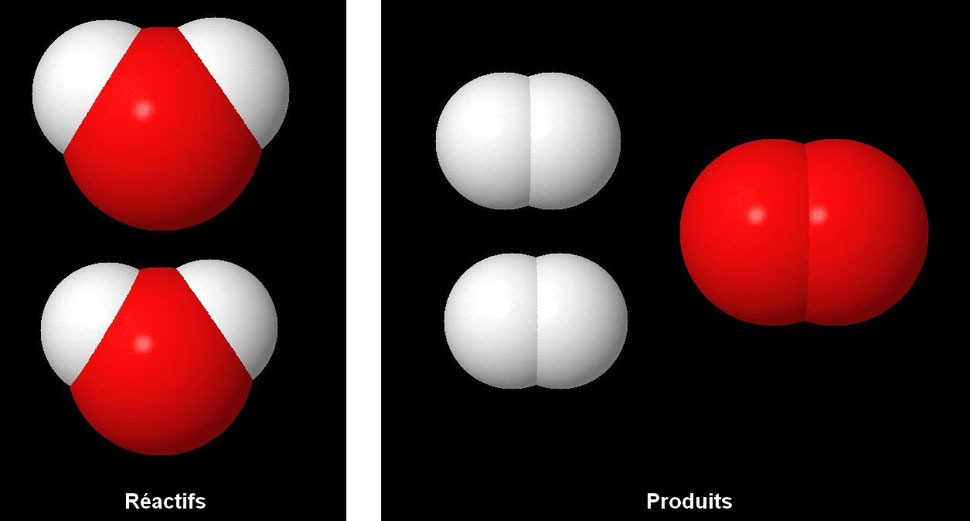
Nous comptons maintenant parmi
:
- les réactifs : 4 atomes hydrogène (blanc) et 2 atome oxygène (rouge),
- les produits : 4 atomes hydrogène (blanc) et 2 atomes oxygène (rouge).
C'est équilibré : il y a conservation des atomes.
Lors d'une transformation chimique, tous les atomes des réactifs se sont réarrangés pour former
de nouvelles substances appelées produits.
Définition 5 :
On appelle équation de réaction l'écriture du bilan à l'aide des symboles et
formules chimiques des réactifs et des produits de la transformation chimique.
Une équation de réaction doit toujours être équilibrée.
À partir des modèles dessinés ci-dessus, nous pouvons donc écrire :
2 x H2O → 2 x H2 + O2
C'est l'équation de réaction d'électrolyse de l'eau.
"2 x" sont les coefficients de cette équation.
FIN
Envie de reproduire les molécules vues dans ce cours ?
http://www.librairiedemolecules.education.fr/outils/scribmol/comp.html#fichiers
Onglet Fichiers : utiliser les noms "eau", "dihydrogen" et "dioxygen"
Onglet Outils : utiliser la première représentation "Afficher en sphères"
Onglet Export : choisir la couleur du fond
Exercice
La photosynthèse permet aux plantes d'utiliser l'énergie solaire afin de fabriquer les substances qui leur sont indispensables pour vivre. Les nutriments nécessaires à la plante sont notamment le dioxyde de carbone (CO2) et l'eau. C'est une transformation chimique qui conduit à la formation de glucose (C6H12O6) et de dioxygène.
Pendant la nuit, la photosynthèse n'a plus lieu et la plante respire comme tout-être vivant.
1/ Écrire les noms ET formules des réactifs mis en jeu lors de la photosynthèse.
2/ Écrire les noms ET formules des produits de la photosynthèse.
3/ Écrire le bilan de la photosynthèse. (pas de formules !)
______________________
4/ Combien d'atomes carbone possède une molécule de dioxyde de carbone ? Expliquer.
5/ Combien d'atomes hydrogène possède une molécule d'eau ? Expliquer.
6/ Combien d'atomes de chaque sorte possède une molécule de glucose ? Expliquer.
______________________
7/ Écrire l'équation de réaction correspondant à la photosynthèse.
8/ Équilibrer cette équation de réaction. (c'est une question difficile ! Les formules écrites à la réponse 7 ne doivent pas être modifiées... il faut "juste" introduire trois coefficients autres que "2"...)
Exercice 2
L'aluminium (symbole : Al ) est un métal léger, très utilisé dans l'industrie comme l'aéronautique : il est fabriqué à partir de la bauxite, un minerai qui contient de l'alumine. L'alumine est un oxyde d'aluminium de formule chimique Al2O3.
La transformation chimique est réalisée à haute température : l'alumine est fondue dans une cuve contenant du carbone (symbole : C ).
Apparaissent alors de l'aluminium liquide qui se dépose au fond de la cuve et du dioxyde de carbone qui s'échappe de la cuve.
1/ Écrire les noms ET symbole ou formule des réactifs mis en jeu lors de la production d'aluminium. (On parle de symbole chimique pour un atome, et de formule chimique pour une molécule)
2/ Écrire les noms ET symbole ou formule des produits de cette transformation chimique.
3/ Écrire le bilan de la transformation chimique. (Rappel : pas de formules dans un bilan !)
______________________
4/ Combien d'atomes oxygène possède une molécule d'alumine ? Expliquer.
5/ Combien de molécules alumine sont nécessaires pour la présence de 6 atomes oxygène ?
6/ Combien d'atomes oxygène possède une molécule de dioxyde de carbone? Expliquer.
7/ Combien de molécules dioxyde de carbone sont nécessaires pour la présence de 6 atomes oxygène ?
______________________
8/ Écrire, sans équilibrer, l'équation de réaction correspondant à la production d'aluminium.
9/ Équilibrer cette équation de réaction, en commençant par équilibrer les atomes oxygène, en tenant compte des réponses 5/ et 7/. (Les formules et symboles écrits à la réponse 8 ne doivent pas être modifiés... il faudra introduire quatre coefficients, qui peuvent être différents !)
